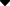黑木耳(Auricularia auricula)是我国广泛栽培的食用菌品种。随着黑木耳栽培产业的不断扩大,促进产业健康发展的关键是优良菌种。目前使用的菌株主要来自野生菌株的分离和自然诱变育种,原生质体诱变育种和杂交育种的研究较少[1,2]。早在1972 年,DE VRIES 和WESSELS 就使用裂合酶分离裂褶菌的原生质体[3]。 20世纪80年代以后,食用(药用)菌原生质体技术得到广泛发展[4~6]。目前,食用菌原生质体技术已成为食用(药)用真菌生理、生化、遗传基础理论研究和菌种改良的有效手段[7]。原生质体融合技术研究和单核杂交技术研究都是以原生质体的成功制备和再生为基础的[8~10]。本文对黑木耳原生质体的制备和再生条件进行了探讨,并对制备的单核菌株进行荧光染色鉴定,为黑木耳菌株的选育提供参考。 1 材料与方法1.1 材料1.1.1 菌株黑木耳菌株黑29、8808、981、HW2、HW5和139由黑龙江省科学院微生物研究所提供。 1.1.2 培养基OSF培养基: 洋葱200g(熟汁),蔗糖10g,阿魏酸0.06g,加水至1000mL,用于木耳原生质体制备前的菌丝体培养。液体再生培养基: 土豆200g(煮汁),甘露醇109.3g,葡萄糖20g,蛋白胨2.0g,KH2PO4 3.0g,酵母膏2.0g,MgSO4 1.5g,维生素B1 10.0mg,加水至1000mL,原生质体用孵化。 CYM 培养基: 土豆200 g(煮汁),葡萄糖20 g,维生素B1 10.0 mg,KH2PO4 3.0 g,蛋白胨2.0 g,酵母膏2.0 g,MgSO4 1.5 g,琼脂20 g,加水至~1000 mL,待用高渗再生培养基。高渗再生培养基:CYM培养基分别加入蔗糖、甘露醇、MgSO4和KCl,浓度为0.5 mol/L,用于原生质体再生菌落筛选。 cPDA 培养基: 马铃薯200 g,葡萄糖20.0 g,硫酸镁1.5 g,KH2PO4 3.0 g;蛋白胨0.5 g,维生素B1 10.0 mg,琼脂粉14.0 g,水1000 mL 菌种培养。 1.1.3 试剂0.6 mol/L MgSO4 高渗溶液; 0.5 mol/L KCl、MgSO4、蔗糖、甘露醇渗透剂:配制0.05 mol/L pH 5.8磷酸盐缓冲液; 0.5%、1.0%、~1.5%溶菌酶:用0.05 mol/L pH 5.8磷酸盐缓冲液配制0.6 mol/L MgSO4,再用MgSO4溶液配制溶菌酶溶液;荧光核染料Hoechst33258: 用0.1 mol/L 柠檬酸缓冲液,pH 7.2 制备荧光核染料[11]。 1.2.方法1.2.1。向菌丝体培养试管斜面加入5 mL OSF培养基,用接种针挑起菌种表面的菌丝,将培养液接种到装有?80 mL OSF培养基(250 mL ),25静置培养,备用。 1.2.2?原生质体制备条件的选择以29株为材料,利用正交试验表L9(3?4)进行原生质体制备条件的优化实验。测试因素和水平见表1。在无菌条件下,用120目尼龙网过滤收集黑29菌株培养得到的菌丝体,用无菌水洗涤一次,用0.6 mol/L MgSO4高渗溶液洗涤,2000g离心10分钟,将收集到的菌丝体用0.6 mol/L MgSO4高渗溶液冲洗一遍,2000g离心10 min,用无菌滤纸吸干,按菌丝体:酶液=1:2?(mV)的比例,加入酶液,振荡2 min,混匀,不同温度振荡不同时间,无菌条件下用300目尼龙网过滤,滤液用无菌管收集,用?0.6 mol/L MgSO4漂洗两次高渗液,3000g离心5分钟,用0.5 mol/L MgSO4渗透剂洗涤离心沉淀? (3000g, 5 min) 2 次,用0.5 mol/L MgSO4 稳定,渗透剂稀释至一定体积后,在血细胞计数器上计数原生质体数。 1.2.3 正交试验后原生质体再生将配制好的原生质体溶液稀释至210?取0.1 mL平板中原生质体,用?0.5 mol/L蔗糖高渗再生培养基包被,使每平板原生质体数达到10?3,25 培养20天,再生菌落数观察板。原生质体再生率计算: 再生率=再生菌落数/原生质体总数100%。
1.2.4 渗透剂对原生质体再生率的影响收集菌株8808、黑29、981、HW2、HW5、139培养获得的菌丝,加入0.5 mol/L蔗糖、甘露醇、硫酸镁、氯化钾作为渗透压稳定剂,其他因素参考正交试验筛选出的最优条件,按1.2.2操作制备原生质体。使用相应的高渗再生培养基,按1.2.3操作进行原生质体再生,计算再生率,确定最佳渗透稳定剂型号。使用筛选后的渗透剂配置0.3 mol/L、0.5 mol/L、0.7 mol/L一系列浓度,按上述方法制备和再生原生质体,计算再生率。 1.2.5?原生质体再生菌株培养挑取包被蔗糖高渗培养基的萌发菌落,在cPDA斜面25培养15天,对获得的菌株进行编号,4保存备用。 1.2.6.单核和双核菌株的荧光显微镜核相检测将每株双核菌株和再生的原生质体菌株接种在直径为88 mm的cPDA板上。
点约15 mm 处插一无菌盖玻片,25 ℃静置培养,待菌丝爬至2/5插片时,取已爬壁的菌丝插片,菌丝面向下,扣于已滴染色液的载玻片上, Hoechst33258染料染色3 min,于荧光显微镜下观察菌丝核相,确定单、双核菌株[11]。? 2 结果与分析 2.1?原生质体制备、再生正交试验结果 由表2可见,原生质体制备最佳条件组合是A2B3C1D2,即酶解温度31 ℃、酶浓度?1.0%、菌龄5 d、酶解时间4 h。从R值可知,酶解温度对原生质体产量影响最大,其次依次为酶浓度、菌龄和酶解时间。 表3为原生质体再生率正交分析结果。表3表明,原生质体再生率最佳条件组合是A3B3C3D1,即酶解温度27 ℃、酶解时间4 h、酶浓度1.5%、菌龄11 d。对黑木耳原生质体再生率影响最大的因素是酶解温度,其次为酶解时间和酶浓度,影响最小的因素是菌龄。2.2?稳渗剂对原生质体再生率的影响 表4为0.5 mol/L的蔗糖、甘露醇、硫酸镁和氯化钾为渗透压稳定剂时原生质体再生的结果。表4表明,稳渗剂对黑木耳原生质体再生有很大影响,蔗糖对黑木耳原生质体再生效果最佳,再生率最高可达2.4%,其次为甘露醇和硫酸镁。氯化钾为稳渗剂时,原生质体再生效果最差,培养过程中无菌落萌发。相同条件下来源于不同菌株的原生质体其再生率也不同,以蔗糖为稳渗剂时,139菌株原生质体再生率最低,而HW2、HW5菌株的再生率较高。 表5是以0.3 mol/L、0.5 mol/L、0.7 mol/L蔗糖为稳渗剂时,不同菌株原生质体的再生率。当蔗糖浓度为0.5 mol/L时,各菌株的原生质体再生率最高,在此浓度下HW5和HW2的再生率分别达2.4%和2.1%。
2.3?不同菌株原生质体单核化比率 表6为不同菌株原生质体单核化比率。表6表明,单核比率最高的是HW2菌株,为35%;981菌株单核比率最低,仅为14%。
2.4?单、双核菌株的荧光显微镜核相 图1可见,荧光显微镜下各菌株单、双核清晰可辨,供试的6个菌株制备的单核,其菌丝分枝较双核菌株少,核距远,菌丝交叉较少,在cPDA培养基上生长较细弱。? 3 讨 论 正交试验结果表明,对原生质体制备及再生影响最大的因素是酶解温度,菌龄对原生质体制备影响较大,但对再生率影响较小;酶解时间对原生质体制备率影响不大,但对再生率有一定的影响;黑木耳原生质体制备的最佳条件是酶解温度31 ℃、酶浓度1.0%、菌龄5 d、酶解时间4 h;原生质体再生的最佳条件为酶解温度27 ℃、酶解时间4 h、酶浓度1.5%、菌龄11 d。? 稳渗剂对原生质体维持正常的渗透压至关重要,其种类和浓度对原生质体的分离有着较大影响[12]。据报道,无机盐、糖类及糖醇都是适宜的渗透压稳定剂[4],不同稳渗剂对原生质体制备、再生有很大的影响[13,14]。本研究表明,以?0.5 mol/L蔗糖为稳渗剂时有利于黑木耳各菌株原生质体的制备和再生。
荧光核相观察是一种较直接的鉴别单、双核菌丝的方法,是目前快速区分单、双核菌丝的有效方法,荧光显微镜下单、双核菌株清晰可辨,但要鉴别两个核是同源或异源,还必须结合其它分析方法。本实验通过核相观察,确立了单核和双核菌株,为进一步核相鉴定提供了试验材料。研究还发现单核菌株在cPDA培养基下培养易形成分生孢子,具体的形成规律和机理尚有待进一步研究。