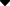1.一级结构
从哺乳动物胰腺中提取的PLA2、蜂毒和蛇毒具有相似的性质,均具有对热和变性剂稳定、耐酸、酶活性依赖于Ca2+、分子量小等特点。由于上述性质,推测它们的结构也相似。这些分子的分子量并不大(约14000),而且是肽链,这使得人们很容易确定其氨基酸序列。目前,有30 多种?确定了1^82 的一级结构。此外,测定了与PLA2有同源关系的蛋白质或亚基,多为突触前神经毒素或其亚基,如Taipantoxin的第7链和Bungarotoxin的B链。 PLA2及其同源蛋白的氨基酸序列可参考Ver-heij等人的综述文章。 (1981)。
比较各种PLA2 的氨基酸序列清楚地表明它们是一类同源分子,可能来自相同的祖先基因。 PLA2中二硫键的测定是以牛或猪胰腺PLA2为材料进行的。经过反复实验和多次修改,确定两个PLA2分子中有7对二硫键。牛胰脏? 1^82前体的二硫键配对如图3-15-4所示。目前对蛇毒中PLA2 的二硫键配对研究不多,
它是通过与牛胰腺PLA2的比较和推测确定的。从氨基酸序列来看,
眼镜蛇毒和海蛇毒中PLA2的半胱氨酸位置与哺乳动物胰腺中PLA2的半胱氨酸位置相似,推测它们之间的二硫键配对相同。响尾蛇毒液和蝰蛇毒液中的PLA2,11位和77位没有半胱氨酸,但50位和C端有半胱氨酸,这两个半胱氨酸可能形成二硫键。 Heinrikson (1977) 在其早期工作: 中将PLA2 分为两类。第一类包括胰腺PLA2,海蛇毒和眼镜蛇毒中的PLA2;第二类包括响尾蛇毒液和毒蛇毒液中的PLA2。随着对更多蛋白质序列进行测序,在二硫键的位置上发现了异常。例如,-银环蛇毒素的B链和从蛇毒中分离出的PLA2都没有CyS11-Cys77这对二硫键,这两种蛋白均来自眼镜蛇蛇毒。
PLA2 中的众多二硫键稳定了其性能。酶活性需要正确的二硫键配对。如果所有的二硫键都被还原打开,酶的活性就会消失。在氧化还原的PLA2恢复其结构的过程中,如果条件不合适,只能恢复部分活性,有时甚至根本无法恢复。 VanSCharrenburg(1980)以猪胰腺PLA2为材料发现,当还原的PLA2被重新氧化时,如果没有苏糖醇,只有35%的酶活性得到恢复。作者将相对较低的回收率归因于二硫键的错配。如果在半胱氨酸和0.9mol/L盐酸胍存在下进行氧化,氧化则有90%95%的酶活性恢复。盐酸胍的作用是增加还原态?溶解度1^82。上述氧化后的酶与自然状态下的酶是一样的。 Verheij 等人。 (1981)计算了不同来源的29个PLA2的一级结构差异,发现它们的氨基酸序列平均相差50%,表明各种PLA2具有很大的同源性。其中Hydrophis蛇毒PLA2与澳大利亚虎蛇毒PLA2较为相似。唾液和非洲眼镜蛇的分类差异比较大,这与它们PLA2序列的较大差异是一致的。从PLA2序列来看,眼镜蛇(C0h)蛇毒PLA2与哺乳动物胰腺PLA2相似,但与蝰蛇毒PLA2差异较大。很明显,眼镜蛇和哺乳动物PLA2 都从祖先蛋白经历了有限的突变进化,并且两者是平行进化的。
比较PLA2的氨基酸序列还发现,PLA2中有32个氨基酸是绝对不变的,29个氨基酸可以被其他具有相似性质(分子大小、电荷或疏水性)的氨基酸替代。如果仅将胰腺pla2与眼镜蛇PLA2进行比较,保守氨基酸有36个,可被同类氨基酸替代的氨基酸多达45个。保守氨基酸包括发挥催化作用(His48、Asp99)、结合辅因子Ca2+ (Asp49) 或具有重要结构功能(例如所有Cys、5 个Gly 残基)的残基。
PLA2与底物的结合是疏水性的分子相互作用,无论底物是分子单体形式还是聚合物颗粒形式。分析PLA2活性位点周围的基团有助于阐明PLA2与底物结合的机制。 X射线分析证明,牛胰腺PLA2的活性位点周围存在多条疏水侧链。这些疏水侧链并不埋藏在分子内部,而是与外界环境接触,从而在PLA2分子表面形成疏水区域,可以与脂质底物结合。对于牛胰PLA2,该区域的氨基酸侧链为LeU2、Trp3、LeU19、Leu20、Leu31、Lys56、Leu58 (Val-Leu-Cal65)、TyrS9、Thr7。在其他PLA2 分子中,这些侧链高度可变,但一些主要的疏水侧链是恒定的。这个疏水区含有多个Arg或Lys,但只有一个带负电荷的侧链基团,净电荷为正,说明与底物结合不仅需要疏水区,而且带正电荷也非常有利于的约束力。对于蛇毒PLA2,这种与底物结合相关的疏水区域类似于胰腺PLA2。由于疏水区的侧链数量超过10条,可以想象,单个侧链的突变不会影响结合效果的性质,而只会影响结合效果的强弱。
有两种蛋白质具有PLA2 结构但没有PLA2 活性。一个是NotechisI-1,另一个是tipantoxin的I链。 NotechisI-1具有结合Ca2+的功能,也可以与PLA2的不可逆抑制剂结合。 NotechisI-1在结构上与Elapid蛇毒PLA2相似,仅30位有1个氨基酸差异,属于正常
PLA2的30位是不变氨基酸Gly3。NotechisI-1的第30位是丝氨酸。该突变位点可能与Ca
2+的结合有关,因而可以设想,尽管突变没有改变对Ca2+的亲和性,但结合的部 位可能发生了变化,与正常PLA2的结合部位不同。这种差异可能是导致Notechis 1-1 无酶活性的原因。和PLA2相比,泰攀毒素的7-链在结构上有几个突出的特点:①在N-端 多出一个8肽,这和胰脏PLA2的前体N-端相似;②假如15位和19位的半胱氨酸形成二 硫键,那么在该分子活性部位的前面有一个附加环,这一环在正常PLA2是没有的;③该 蛋白链的31位为Pro,而正常PLA231位不是Pro,31位柯近这段肽对Ca2+的结合有重 要作用;④在第55位和第68位之间无缺失;⑤有一个多糖链结合在Asn7。上,而ASn7。正 好处在活性中心的前面。胰脏PLA2的前体不能水解以微粒状态存在的底物,但能有效地分解以单分子状态 存在的底物。这种差异是由于前体在N-端多了几个氨基酸残基。有人报道这段肽含3个 氨基酸,也有人报道含有5个氨基酸,还有人报道含有7个氨基酸。但无论那种情况这段 肽的C-端都是精氨酸。
早在1972年就有人提出PLA2中的a-氨基在分子内部形成盐键,对活性部位的空间 结构起到稳定作用。经测定,氨基的PK值为8. 3〜8. 9,这与假设相符。如果用其他氨基 酸取代Ala,,酶的活性会大大下降,这从另一方面说明维持这种盐键的重要性。X射线衍 射证明Ala,确实包埋在分子的内部。其中的a-氨基通过水分子与Asp99形成盐键。
我国对PLA2结构的研究起步较晚,主要工作由陈远聪等人完成。他们从浙江蝮蛇毒 中纯化出酸性、中性和碱性3种PLA2,分子量相近(约14 000)。中性PLA2是突触前神经 毒素,酸性PLA2是血小板聚集抑制剂,碱性PLA2有极强的溶血活性。在完成了酸性 PLA2的全部氨基酸顺序和中性PLA2、碱性PLA2的化端部分顺序测定后,他们发现这3 种PLA2的N-端顺序非常相似,只有少数氨基酸残基有变换,可能C-端的差别较大。关于 它们的空间结构以及结构与功能的关系还有待于进一步研究。
二、化学修饰对活性的影响
对PLA2的化学修饰研究已经进行了 20多年,化学修饰的主要目的是弄清酶的活性 部位,从而为彻底弄清酶的催化机制打下基础。一般地说,如某种残基被修饰后酶失去 活性,那么这种残基被定义为必需基团,它是活性部位的组成成分。如经修饰后仅仅使 酶的活性部分下降,或者仅使结合某种底物的特性改变,这种被修饰的基因可能仅是较 重要而已,谈不上是必需基团。在测定PLA2活性时,用以单分子状态存在的磷脂为底物, 一方面是因为以这种形式为底物时,PLA2只要有活性就能测定出来,反应了它水解底物 的活性大小;另一方面是如用微粒状态的磷脂为底物,会出现这样的情况:即某种修饰 剂作用于PLA2某种特殊残基后,这个残基尽管不是活性中心的组成成分,也会导致酶活 的全部丧失。这种修饰作用把PLA2转变成和前体相似的物质,虽然对微粒状态的底物无 活性,而对单分子状态的底物仍有分解作用。这种现象可能是由于修饰作用影响了 pla2 中与微粒状态底物结合的部位的性质,使之不能与底物结合,而不是修饰了分解底物的 活性中心。
(一)丝氨酸
各种有机磷化合物如DFP都不能抑制PLA2的活性,这说明活性部位没有丝氨酸存 在。过去有人考虑到PLA2的活性部位含有较多的疏水氨基酸,所以改用疏水性较大的丝 氨酸修饰剂进行修饰。但以乳化形式或以变性剂混合成微粒形式的上述修饰剂都不能使 猪胰脏PLA2失活。现在普遍认为丝氨酸不是PLA2活性部位的组成成分。这和以牛胰脏 PLA2为材料进行的X射线分析结果相符,X射线分析发现牛胰脏PLA2的活性部位无 丝氨酸。曾有人报道DFP可以抑制从蛇毒中分离的PLA2的活性,这种抑 制作用可能不是作用于丝氨酸残基所致。
(二)巯基
由于PLA2中的半胱氨酸都形成了二硫键,故一般认为PLA2的活性部位没有巯基。 过去曾有人报道某些巯基修饰试剂可以改变pla2活性,这可能是由于这些修饰剂与巯 基以外的基团作用的结果。
(三)组氨酸
1966年就有人估计组氨酸可能是PLA2的活性部位组成成分。以后用对-溴苯甲酰甲 溴(BPB)作修饰剂证明了这一点。更详细的研究发现,猪胰脏PLA2和它的前体PLAZ对 BPB反应的动力学相似,说明这2种蛋白质被修饰的是同一种残基。当修饰作用使酶活 性下降到原活性5%以下时,氨基酸分析结巣表明1分子pla2减少了 1个组氨酸,用 PLA2前体作试验也有相似的结果。分析还表明,用BPB做修饰剂时,它主要与紐〜结 合,其次是(约10%)与His115结合。用没有His115的马胰脏PLA2为材料,发现BPB只能与 His48结合,说明HI48是BPB最易修饰的组氨酸残基。经修饰后PLA2对任何状态的底物 都无催化作用。
Ca2+是PLA2绝对需要的辅助因子,无论PLA2还是它的前体都需要与Ca2+结合。 Ca2+能够阻止BPB对PLA2的修饰作用,但Mg2+对此无影响。除了 Ca2+外,PLA2的竞争 性抑制剂(D型卵磷脂)、PLA2的水解产物(溶血卵磷脂和脂肪酸)以及不可分解的磷脂 类似物都能阻止BPB的修饰作用,特别是Ca2+和单体状态的D型卵磷脂同时存在时,阻 止作用更强。上述阻止物除Ca2+外,浓度都必须在各自的能形成微粒的临界浓度以下,否 则有时会加强BPB的修饰作用。这说明PLA2可能和上述分子状态底物形成了复合物, 这种复合物对BPB稳定。PLA2和聚集状态的物质很难形成复合物,这可能是在该条件下 BPB仍能起修饰作用的原因。
PLA2和它的前体对修饰剂BPB的反应相似,都能被某些物质和Ca2+保护。从这些 情况来看,PLA2的活性部位在前体形式就已经存在,酶原形式PLA2也能水解单体状态 底物进一步说明了这个问题。各方面的证据还说明PLA2比前体多了 1个与脂-水界面结 合的部位,由于这种原因,前体PLA2不能水解聚合状态的底物(Volwerk,1979)。
各种证据表明祕348是PLA2活性部位的组成成分。测定BPB修饰猪胰脏PLA2时pH 的影响,发现祕348的pKa为6. 2,牛胰脏PLA2 His48的pKa为6. 8,在相同条件下牛胰脏 PLA2被BPB修饰的速度是猪胰脏PLA2的10倍。PLA2被修饰时,单体状态的底物类似 物可以阻止修饰反应,PLA2对它们的亲和力与其中的脂酰基长度有关,一般地说脂酰基 长,亲和力大。这些证据说明His48可能处在疏水区域,BPB也是疏水性修饰剂,His48所处的
环境有利于BPB的修饰作用。在很多情况下修饰作用使酶失去了水解底物的能力,但对某 些底物的结合作用仍存在,这说明PLA2和底物结合的部位与活性部位是有区别的。
用BPB修饰蛇毒PLA2和突触前神经毒素的工作起步较晚。与胰脏PLA2相似,它们 与BPB作用时也有一个组氨酸被修饰。对突触前神经毒素修饰后,这些毒素的PLA2活 性和神经毒性全部消失,这说明完整的活性部位是维持这二种活性的前提。Crotoxin含有 1个酸性A亚基和一个具有PLA2活性的碱性B亚基,完整的Crotoxin不与BPB作用, PLA2活性和神经毒性也不受影响。如B亚基单独与BPB作用,则自身的PLA2活性和神 经毒性都丧失,但仍然能像修饰前那样与A亚基结合。分析发现B亚基中的一个His被 BPB修饰。Crotoxin不被修饰可能因为A亚基对B亚基的活性部位有保护作用。Taipox- in毒素有3个亚基,其中a、卩亚基和PLAZ同源,而7亚基和猪胰脏PLA2前体同源。a、(3 亚基和BPB反应都有1个His被修饰,但7亚基不被修饰。在7亚基的活性部位有1个糖 链,可能这个糖链阻止了 BPB对7亚基的修饰作用。由于用BPB修饰后Tapoxin毒性大 大降低而抗原性仍存在,所以在实验室中常利用这个特性制备Taipoxin的髙效价抗体。 对BPB修饰的组氨酸位置分析表明,绝大多数也发生在His48位置。
Ca2+也能阻止BPB对绝大多数蛇毒PLA2的修饰,但Crotoxin的B亚基例外,即使 在25mmol/L浓度下,Ca2+也不起作用。与胰脏PLA2相似,Notexin和P-Bugarotoxin被 BPB修饰后失去了对Ca2+的结合能力,但印度眼镜蛇、黑颈眼镜蛇和唾蛇蛇毒中PLA2经修饰后活性虽然丧失,但 结合Ca2+的能力仍然存在。PLA2底物类似物有些能阻止BPB对蛇毒PLA2的修饰,有些 不能,从目前情况来看,还不能得出普遍性结论。
(四)色氨酸
用N-溴代琥珀酰亚胺(NBS)修饰东部菱斑响尾蛇蛇毒PLA2发现,每个二聚体形式的PLA2分子有2个色氨酸残基被修饰,修饰作用导致PLA2的失 活和其他光谱特性方面的变化。尽管在修饰过程中PLA2有可能发生解聚,但修饰后的产 物仍是二聚体。用2-羟基-5-硝基苄基溴(HNB)修饰东部菱斑响尾蛇
蛇毒PLA2时,每个分子的二聚体PLA2也有2个色氨酸被修饰,不过修饰后 活性仍然存在,光谱方面的特性也没变。由于每个PLA2单体有3个色氨酸,所以1印31和 NBS修饰的色氨酸可能不同(Heinrikson,1977)。Viljoen等(1976)用NBS修饰加蓬咝蝰蛇毒中的PLA2,他们发现酶活的丧失与Trp31被修饰有关。Ca2+和十六脂 酰胆碱(diC16PC)几乎不能对抗NBS的修饰作用,但以微粒状态存在的溶血卵磷脂,特别 在有Ca2+存在时,确实能够阻止对Trp31的修饰。虽然Viljoen曾经认为丁印31是PLA2的 活性部位组成成分,但以后他又解释说Trp31可能与底物结合有关,这一解释和大多数 PLA2Trp31部位的氨基酸可变相符合。在其他许多PLA2中, 第31位不是色氨酸而是其他 氨基酸。从加蓬咝蝰蛇毒中分离出的PLA2可以被邻-硝基苯磺酰氯 (NPS)修饰,修饰作用主要集中在Trp7。残基上,活性没有改变。如果条件剧烈些可以进一 步引起Trp31被修饰,活性也相应地有些下降。经过NBS修饰后的PLA2还可以被NPS 修饰。猪胰脏PLA2 的Trp31被NPS修饰后,如用以微粒状态的底物辛脂酰卵磷脂测试, 活性没有变化;但如用卵黄为底物,则活性只有原来的一半。
从半环扁尾蛇蛇毒中可以分离出4种PLA2,其中有3种 PLA2 第70位上无Trp,这3种PLA2的活性比另一种PLA2的活性低。Yoshida以 第70 位上有Trp的PLA2为材料,用NBS对Trp7。进行修饰,发现修饰后PLA2酶活有较大程 度的下降,修饰后产物的活性和前3种PLA2相似。有趣的是修饰后产物水解底物的动力 学也发生了变化,与70位没有Trp的PLA2相似。Howard和Tmag(1977)报道用NBS 修饰卜银环蛇毒素后,产物的神经毒性和PLA2活性均消失。Howard和Truag都可以对 印度眼镜蛇(iV. na知蛇毒中的PLA2进行修饰,修饰的残基仍是Trp,修饰后酶的 活性绝大部分都有较大的下降。这些PLA2分子中有3个分子的Trp残基,现在还不知道 是否对这3个Trp都有修饰作用。这种修饰可能通过改变PLA2对底物的结合作用而使 酶失活。
(五)甲硫氨酸
从东部菱斑响尾蛇細蛇毒中分离出来的PLA2可以与2-溴乙酰 胺-4-硝基苯酚作用,结果修饰了 PLA2中间的1个甲硫氨酸Metlo,当每摩尔PLA2单体 结合0. 75mol对-硝基苯酚基团时,酶的活性仍然存在。马和牛胰脏PLA2以及猪胰脏 PLA2都只有一个甲硫氨酸Met8,对这些PLA2羧甲基化只能引起活性极小的降低,进行 长达22h修饰后,仍有65%的酶活存在。但当有8mol/L尿素存在时,猪胰脏PLA2失活 的速度要快得多。失活的酶对微粒或单体形式的底物都无作用。直接结合试验表明失活 的PLA2不能和脂-水界面结合,但仍能和单体状态的底物类似物以及Ca2+结合,只不过 结合强度要弱而已。过去认为Met8是与识别底物有关的基团,但X射线衍射分析证明牛 胰脏PLA2的Met8包埋在分子的内部,这说明上述判断很可能有误。
猪胰脏PLA2除厘《8以外在20位还有1个Met2。,在没有尿素存在的温和条件下, Met2。就可以很快被羧甲基化,而在这样的条件下Met8几乎不被修饰。Met2。被修饰后, PLA2活性降低一半,对修饰的时间延长并没有使猪胰脏PLA2失活加剧,但对Met2。的羧 甲基化在增加,用甲基碘作为修饰剂时也有类似的情况。用修饰方法可以制备出S-羧甲 基-Met2。猪胰脏PLA2和S-甲基-Met2。猪胰脏PLA2。这2种修饰产物对单体状态底物的 水解活性没变,对单体状态底物、Ca2+以g微粒状态的PLA2底物类似物的亲和力也不 变,但对底物单分子层的穿透能力大大降低。S-羧甲基-Met2。猪胰脏PLA2对卵黄的水解 能力只有原来的一半。综合各方面材料,现在认为Met2。和Met8可能是与底物结合有关的 基团。
(六)赖氨酸
Viljoen(1977)以加蓬咝蝰蛇毒中的PLA2为材料,先用5'-磷酸吡哆 醛修饰,然后用氢硼化钠还原,结果酶的活性丧失。他认为Lys是PLA2的活性部位组成成 分。微粒状态的溶血卵磷脂可以阻止上述试剂对Lys的修饰,但Ca2+对此无影响。修饰作用 发生在4个Lys上,每种被修饰的程度大约25 %。从修饰反应的一级动力学来看,修饰作用 不涉及其他基团,否则就会使动力学性质不是单一的一级反应。当每个PLA2分子和1个 5'-磷酸吡哆醛分子结合后,酶的活性即消失,因此普遍认为修饰作用在活性部位进行。
可以先对PLA2吡哆醛化,然后用3H-标记的氢硼化钠还原来制备放射性的卩-银环蛇毒 素,制备后的卩-银环蛇毒素活性没有变化,但对神经组织结合的解离常数增加10倍左右。
(七)羧基
Zhelkovskii等(1978)用N-重氮乙酰基-N'-(2,4-二硝基苯基)-亚乙基二酰胺(DBE) 修饰iVajan. oriana蛇毒中的PLA2,修饰反应体系中有Ca2+存在。当每个以二聚体存 在的PLA2分子中1个羧基被修饰后,酶对L-丁脂酰卵磷脂(L-diC4PC)的水解作用完 全消失。二氨基吖陡是PLA2的一种竞争性抑制剂,这种抑制剂和Ca2+都不能阻止上 述修饰作用。修饰后用氢硼化钠还原并对修饰产物分析,发现修饰作用具有选择 性。
为了获得关于活性部位以及和Ca2+结合部位是否有羧基的知识,Fleer (1981)用水 溶性的修饰剂1-乙基-3-(N,N-二甲基)氨基丙基碳化二亚胺(EDC)和氨基脲作为修饰剂 对牛胰脏PLA2的羧基进行修饰,结果发现除八印99或Asp39不被修饰外,其他的羧基都可 以被修饰,修饰后产物失去酶的活性,也失去结合Ca2+的能力。在有Ca2+存在下,除Asp39 和Asp99不被作用外,Asp49也不被修饰。Asp49不被修饰的蛋白质仍具有酶的活性,也能结 合Ca2+。这样看来Asp49是结合Ca2+的基团,这种结论和用X射线对牛胰脏PLA2的分析 结果相符合。从pH对牛胰脏PLA2结合Ca2+的影响来看,pKa为5. 25,这一数据和Asp49 与Ca2+结合有关这一假设相符合。
(八)精氨酸
Vensel和Kantr0witZ(1980)用苯甲酰甲醛为修饰剂,证明猪胰脏PLA2活性部位中 有1个精氨酸残基。用该修饰剂时,大约每分子PLA2有1个Arg被修饰,但这种数量上 的关系不明显,酶活性降低的程度好像也不与修饰Arg数量的多少绝对相关。Ca2+不能 阻止修饰作用,但以微粒状态存在的化合物n-烷基磷酯酰胆碱则有阻止作用。当pH从
6.5升高到9. 5时,酶被修饰的速度加快,但上述底物类似物阻止修饰的效率下降。已知 苯甲酰甲醛有转氨作用,反应甚至比修饰Arg还快。自由氨基的存在对酶与底物结合及 酶活是很重要的,上述修饰作用的结果到底由转氨引起还是由对Arg修饰引起是应该搞 清楚的。VerSel(1980)极力证明失活作用确实由修饰Arg引起,但仍然有反对意见。2,3- 二丁二酮和1,2-环己二酮对精氨酸的修饰比苯甲酰甲醛更专一,这2种物质即使在较大 浓度下也只能引起酶活性较小的降低。Verheij(1981)发现,苯甲酰甲醛既有修饰Arg的 作用,也有转氨作用,修饰Arg的数量依苯甲酰甲醛的浓度大小而定。如果苯甲酰甲醛的 浓度低于Vensel(1980)所用的浓度,可以使猪胰脏PLA2失活。失活的PLA2对CNBr裂 解敏感。CNBr裂解后,PLA2在1^-端少了一个8肽,对除去8肽的PLA2进行氨基酸分析 发现,Args减少80%,Alai几乎全部消失。把猪胰脏经e-脒化的PLA2的氨基先保护起 来,然后进行修饰,最后把保护基团除去,结果发现修饰后产物仍有很大的活性,Fleer 用14C标记的1,2-环己烷二酮在硼酸盐存在下修饰猪胰脏PLA2的Arg,尽管有些PLA2 发生转氨反应,但仍然能分离出只在Args位上发生修饰反应的PLA2。对这种PLA2的研 究发现,它对单体或微粒状态底物反应的以及和Ca2+的结合特性没有变化,和未修 饰前相比,它对微粒状态底物类似物的亲和力增大了,对卵磷脂单分子层的穿透能力也加 强了。
(九)氨基
在Cu2+存在下,二羟己酸可以使蛋白质中的氨基发生特异的转氨作用。在这种物质作用下,猪和马胰脏PLA2都会很快失活,而牛胰脏PLA2却稳定得多。Ca2+和单体状 态的PLA2底物类似物对修饰无影响,但以微粒状态存在的底物类似物却能有效地阻止 上述修饰剂对猪胰脏PLA2的修饰。为了弄清修饰反应的特异性,使用缺乏氨基的猪胰 脏PLA2前体为修饰对象,以PLA2为对照做平行实验,结果发现当PLA2活性丧失80% 时,对PLA2前体有15%潜在的活性丧失。由于前体中无a-氨基,所以这种失活是由副反 应引起的,延长反应时间可以加剧前体潜在活力的丧失。由于二羟己酸与精氨酸修饰剂 («、|3二酮)的结构相似,所以不能排除Arg也被修饰的可能性,特别是C-端肽段中的Arg 有可能被修饰,因而阻止了酶原的正常激活作用。对Arg的修饰确实是使前体变质的原 因,被修饰后的产物在PH8. 0条件下贮存能部分恢复潜在活性,而这一条件是有利于 Arg苯甲酰甲醛连接键断裂的。
当在8mol/L尿素或6mol/L盐酸胍存在下,转氨作用会很快使牛、猪和马的PLA2在 30min〜60min内完全失活,而用同样的条件处理猪胰脏PLA2前体时,前体会被激活成 为PLA2,这种PLA2f再需要进一步激活。
转氨后的猪胰脏PLA2通过离子交换层析可以被分离出来,和未处理的PLA2相比, 只是a-氨基变成了酮基。这种转氨后的PLA2由于对微粒状态底物的结合能力下降,所以 对这种形式的底物水解活性很小,但仍能分解单体形式的底物。从这一点来看转氨后的 PLA2和原来的PLA2前体相似(在水解底物方面),实际上NMR光谱以及X射线分析都 证明转氨后的牛胰脏PLA2具有其前体相似的结构。
和胰脏PLA2相似,从西部菱斑响尾蛇.极北蝰和黑
唇眼镜蛇蛇毒中分离的PLA2在四乙基化尿^存在下与二羟己酸作 用很快就失活,把修饰后的PLA2分离出来测定其性质,结果发现它们对微粒状态的底物 没有作用,但能部分地水解以单体状态存在的底物。转氨后的蛇毒PLA2对脂-水界面的 亲和力比原来下降5倍〜10倍,但仍比转氨后的猪胰脏PLA2亲和能力大得多。猪胰脏 PLA2转氨后亲和力小可能与它的N-端正区域有关,而蛇毒PLA2转氨后亲和力仍很高 可能与分子中另外一个疏水区域有关。