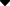血液凝固在级联中得到加强,前一个前体被激活,然后下一个前体被激活,一步一步,最后凝血酶原被激活。许多凝血因子位于血小板磷脂膜上,在活化过程中,被活化的因子形成复合物。根据Kini 等人的模型,抗凝剂PLA2 与某种凝血因子结合,即凝血点蛋白。这种组合会干扰凝血因子之间的相互作用,从而干扰复合物的形成。结合的抗凝剂PLA2可以水解附近的关键磷脂,减弱或停止血液凝固,从而起到抗凝作用,如图5-20-8所示。以上论点可以解释为什么蛇毒中的强抗凝剂PLA2水解血浆磷脂的活性相对较低。非特异性抗凝剂PLA2对血浆磷脂的水解没有特异性,必须水解大量磷脂才能发挥抗凝作用。该模型还表明抗凝活性与PLA2 酶活性无关。
关于抗凝剂PLA2 的抗凝活性是否与酶活性有关,目前仍有争论。与酶活性相关的证据有: His48烷基化可大大降低PLA2的酶活性和抗凝活性; 不能水解的磷脂可以中和PLA2的抗凝作用; 酶活性和酶活性损失PLA2可与磷脂结合; 孵育时间越长,抗凝作用越强; EDTA可以降低PLA2的抗凝作用,EDTA可以去除PLA2活性所必需的Ca2+。有:个证据表明PLA2抗凝剂与水解活性无关:抗凝活性与PLA2酶活性不平行; 血浆中磷脂的水解程度与抗凝强度不平行。 PLA2 只能作用于结合位点附近。 即使血浆磷脂被PLA2强烈抗凝后,抗凝作用仍可被抗血清逆转,抗体可与PLA2结合,将PLA2从特异结合位点解离并阻断水解结论是水解磷脂被置换通过其他磷脂,从而逆转抗凝作用; 赖氨酸的化学修饰表明抗凝作用不依赖于酶的活性,Lys被修饰以中和抗凝活性中心的正电荷,从而失去与PLA2的结合特异性。由于特异性结合的丧失,它们的抗凝作用可能是由血浆磷脂的非特异性水解引起的;凝血因子结合会干扰凝血因子之间的相互作用。它们不能水解磷脂,因此抗凝血活性很弱。